Um an dieser Studie teilnehmen zu können, müssen Sie oder ein/e Angehörige/r:
Weitere Teilnahmekriterien werden vom Studienteam bei Ihrem ersten Termin geprüft.
Haben Sie eine Patientin oder einen Patienten mit Lungensarkoidose, die/der für die Teilnahme an dieser Studie infrage kommen könnte? Wenden Sie sich an unser Studienteam unter efzofit@atyrpharma.com, um eine Patientin oder einen Patienten zu empfehlen und Informationen über das nächstgelegene Prüfzentrum zu erhalten.
Sie treffen sich mit einem/einer Studienkoordinator/in an einem Prüfzentrums-Standort in Ihrer Nähe. Sie erfahren mehr über die Forschungsstudie und die Vorteile und Risiken einer Teilnahme.
Der/die Studienkoordinator/in oder Prüfarzt/Prüfärztin wird die Einwilligungserklärung mit Ihnen durchgehen. Bevor Sie sich entscheiden, ob Sie an dieser Studie teilnehmen möchten, haben Sie die Möglichkeit, Fragen zu den Einzelheiten der Studie und zur Einwilligungserklärung zu stellen. Sie werden nur dann gebeten, das Formular zu unterschreiben, wenn Sie bereit sind, an der Studie teilzunehmen. Nachdem Sie Ihre Einwilligung erteilt haben, werden zusätzliche Screening-Tests durchgeführt, um sicherzustellen, dass Sie sich für die Teilnahme an der klinischen Studie qualifizieren.
Efzofitimod wurde mit dem Ziel entwickelt, chronische Lungenentzündungen zu heilen, was es Patientinnen und Patienten mit Lungensarkoidose ermöglichen könnte, die Verwendung von Steroiden zu reduzieren oder ganz zu eliminieren, während die Lungenfunktion erhalten wird und die körperlichen Symptome verbessert werden. Ziel der EFZO-FIT™-Studie ist es, die Sicherheit und Wirksamkeit von Efzofitimod weiter zu prüfen.
Das Studienmedikament Efzofitimod enthält ein Protein, von dem angenommen wird, dass es hilft, die Entzündung in der Lunge zu reduzieren, die die Lungenschäden und Symptome bei Lungensarkoidose verursacht.
Nachdem Sie die Einwilligungserklärung unterschrieben haben und die zusätzlichen Screening-Tests bestätigen, dass Sie zur Teilnahme an der Studie geeignet sind, werden Sie als Teilnehmerin/Teilnehmer aufgenommen und nach dem Zufallsprinzip einer Behandlungsgruppe (Efzofitimod oder Placebo) zugeteilt.
Die geplante Dauer dieser Studie beträgt etwa ein Jahr. Nach dem ersten Screening-Termin müssen Sie insgesamt 14 zusätzliche Studientermine am nächstgelegenen Prüfzentrum wahrnehmen. Bei den ersten 12 dieser Termine, die einmal alle 4 Wochen geplant sind, erhalten Sie eine intravenöse (i.v.) Infusion von entweder Efzofitimod oder dem Placebo. Bei jedem Studientermin wird eine Vielzahl von standardmäßigen und spezifischen medizinischen Tests (z. B. eine Überprüfung der Vitalzeichen, EKG und Lungenfunktionstests) durchgeführt. Die vollständige Liste aller medizinischen Tests, Untersuchungen und Verfahren kann mit dem Prüfzentrumspersonal besprochen werden. Zwei Wochen nach jedem persönlichen Studientermin werden Sie telefonisch kontaktiert, um Ihren Fortschritt zu überprüfen.
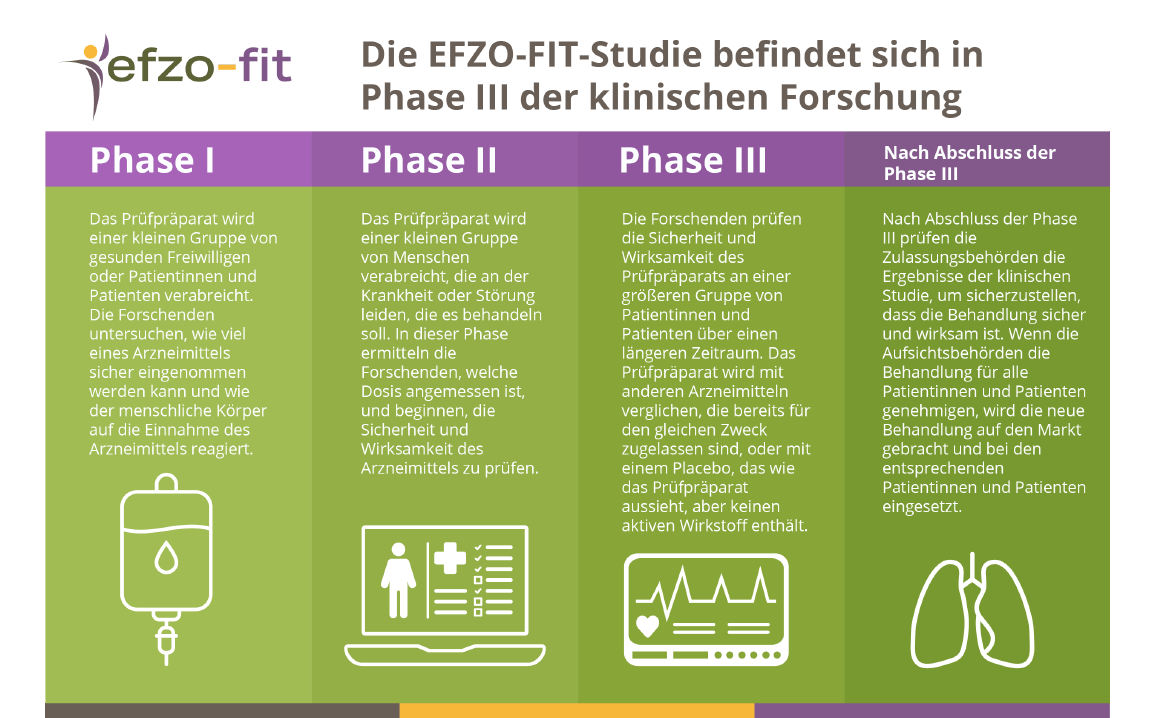
Die EFZO-FIT-Studie befindet sich in Phase III der klinischen Forschung. Ein Prüfpräparat muss drei Phasen der klinischen Prüfung durchlaufen, bevor es von der Aufsichtsbehörde eines Landes zugelassen und der Öffentlichkeit zugänglich gemacht wird. Diese Phasen lauten wie folgt:
Phase I: Das Prüfpräparat wird einer kleinen Gruppe von gesunden Freiwilligen oder Patientinnen und Patienten verabreicht. Die Forschenden untersuchen, wie viel eines Arzneimittels sicher eingenommen werden kann und wie der menschliche Körper auf die Einnahme des Arzneimittels reagiert.
Phase II: Das Prüfpräparat wird einer kleinen Gruppe von Menschen verabreicht, die an der Krankheit oder Störung leiden, die es behandeln soll. In dieser Phase ermitteln die Forschenden, welche Dosis angemessen ist, und beginnen, die Sicherheit und Wirksamkeit des Arzneimittels zu prüfen.
Phase III: Die Forschenden prüfen die Sicherheit und Wirksamkeit des Prüfpräparats an einer größeren Gruppe von Patientinnen und Patienten über einen längeren Zeitraum. Das Prüfpräparat wird mit anderen Arzneimitteln verglichen, die bereits für den gleichen Zweck zugelassen sind, oder mit einem Placebo, das wie das Prüfpräparat aussieht, aber keinen aktiven Wirkstoff enthält.
Nach Abschluss der Phase III prüfen die Zulassungsbehörden die Ergebnisse der klinischen Studie, um sicherzustellen, dass die Behandlung sicher und wirksam ist. Wenn die Aufsichtsbehörden die Behandlung für alle Patientinnen und Patienten genehmigen, wird die neue Behandlung auf den Markt gebracht und bei den entsprechenden Patientinnen und Patienten eingesetzt. Weitere Informationen über den Ablauf und die Überwachung klinischer Studien finden Sie unterhttps://www.ema.europa.eu/en/human-regulatory/research-development/clinical-trials-human-medicines
Die Prüfzentren befinden sich in den Vereinigten Staaten, Puerto Rico, Großbritannien, Deutschland, den Niederlanden, Frankreich, Italien, Spanien und Japan.
Sie müssen Ihre Medikamente vor der Teilnahme an der Studie nicht absetzen, es sei denn, Sie werden vom Personal des Prüfzentrums oder Ihrer Hausärztin/Ihrem Hausarzt dazu aufgefordert.
Nein, für die Studientherapie oder das Studienverfahren entstehen Ihnen keine Kosten. Auch kann eine Reisekostenerstattung für die Studientermine verfügbar sein.
Nein, eine Krankenversicherung ist keine Voraussetzung für die Teilnahme an dieser Studie.
Klinische Studien, auch bekannt als klinische Prüfungen oder Forschungsstudien, werden von Ärztinnen/Ärzten und Forschenden durchgeführt, um festzustellen, ob neue Medikamente oder Behandlungen sicher und wirksam sind. Bevor ein neues Medikament für die breite Öffentlichkeit zugelassen werden kann, müssen klinische Studien abgeschlossen und die Ergebnisse sorgfältig geprüft werden. Die Teilnahme an einer klinischen Studie ist absolut vertraulich und wird wie alle anderen medizinischen Informationen geschützt.
Forschungsstudien werden verwendet, um neue Medikamente auf Sicherheit, Verträglichkeit und Wirksamkeit zu testen, bevor sie für die Verwendung durch die Öffentlichkeit zugelassen werden.
Weitere Informationen zu klinischen Studien finden Sie unter www.clinicaltrials.gov. Dies ist eine Online-Datenbank der US-Regierung, die von der National Library of Medicine verwaltet wird. Sie informiert über staatlich und privat geförderte klinische Forschungsstudien.
Weitere Informationen zu Sarkoidose-Studien und anderen Ressourcen finden Sie unter https://www.stopsarcoidosis.org/find-a-clinical-trial/.
Alle Forschungsstudien erfordern, dass Ärztinnen/Ärzte und/oder Forschende interessierten Teilnehmenden vollständige und genaue Informationen über die Risiken, Vorteile und Aktivitäten einer Forschungsstudie geben. Interessierte Teilnehmende unterschreiben eine Einwilligungserklärung, bevor sie in die Studie aufgenommen werden. Diese Einwilligungserklärung zeigt, dass ein/e Teilnehmer/in versteht, was während der Studie passieren wird, und dass er/sie die Studie jederzeit verlassen kann.
In bestimmten Arten von klinischen Studien erhalten einige Teilnehmende ein Placebo anstelle des experimentellen Medikaments: Ein Placebo sieht aus wie das experimentelle Medikament, enthält aber keinen Wirkstoff. Sowohl die/der Teilnehmer/in als auch die/der Forschende sind „verblindet“, was bedeutet, dass sie während der Studie nicht wissen, welche Teilnehmenden das experimentelle Medikament erhalten. Dies ermöglicht den Forschenden, die Ergebnisse der Teilnehmenden, die das experimentelle Medikament erhalten haben, mit den Ergebnissen der Teilnehmenden zu vergleichen, die das experimentelle Medikament nicht erhalten haben.